Konya’da arabaya binerken silahlı sladırıya uğrayan Mehmet Koçyiğit ve 11 yaşındaki Servet’in öldürülmesine dair başlatılan çalışmada 1 kişi yakalandı.
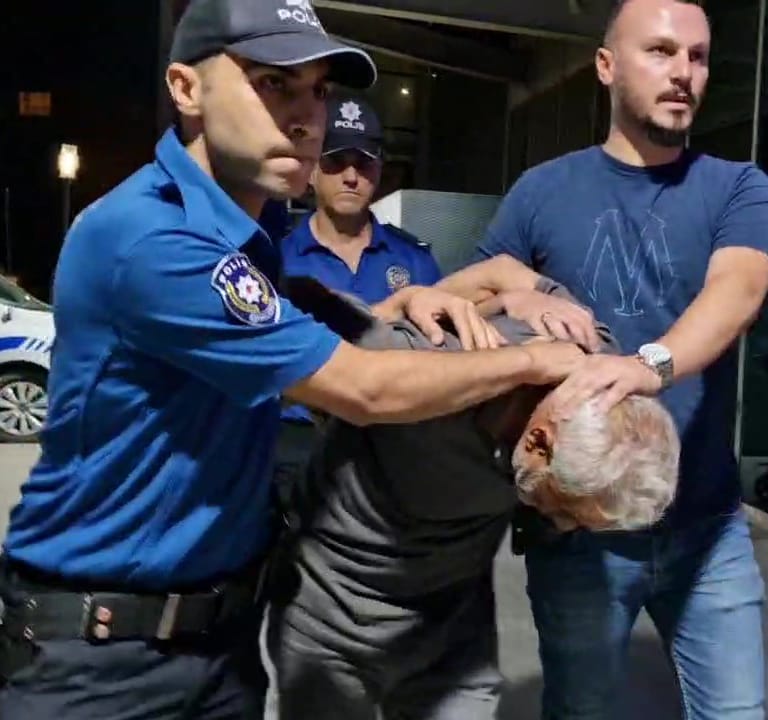
Mısır tarlasında yakalanan kuşkulu Hıdır A., gazetecilerin “11 yaşındaki cocuğu neden öldürdün?” halindeki sorusunu “Görmedim ben, görmedim” diye yanıtladı.
BABA VE OĞLU SİLAHLI AKINDA ÖLDÜ
Pazartesi günü sabah saatlerinde Konya Karatay ilçesi Karaaslan Mahallesi Övgü Sokak’taki apartmanın bahçesindeki arabaya binmek isteyen baba Mehmet Koçyiğit ve 11 yaşındaki oğlu, silahlı atağa uğradı.
Mahallelinin ihabrı üzerine olay yerine gelen gruplar Mehmet Koçyiğit’in hayatını kaybettiği belirlerken, başına ve sırtına mermi isabet eden Servet Koçyiğit ise sıhhat takımlarının birinci müdahalesinin akabinde kaldırıldığ Konya Kent Hastanesi’nde ömrünü yitirdi. Baba ve oğlunun cenazeleri, otopsi için İsimli Tıp Kurumu’na gönderildi.
Baba-oğul, memleketleri Niğde’de bugün toprağa verildi.
 Mehmet Koçyiğit ve 11 yaşındaki oğlu Servet Koçyiğit
Mehmet Koçyiğit ve 11 yaşındaki oğlu Servet KoçyiğitŞÜPHELİ MISIR TARLASINDA SAKLANIRKEN YAKALANDI
Silahlı taarruzla ilgili soruşturma başlatan polis, olaya karıştığı öne sürülen Hıdır A.’yı merkez Karatay ilçesi Çatalhöyük Mahallesi’nde saklandığı mısır tarlasında yakalayarak gözaltına aldı.
Konya Numune Hastanesi’nde sıhhat denetiminden geçirilen Hıdır A., basın mensuplarının “11 yaşındaki çocuğu neden öldürdün?” sorusuna “Görmedim ben, görmedim” diye karşılık verdi. Hıdır A., sözü alınmak üzere Asayiş Şube Müdürlüğü’ne götürüldü.